Формиат аммония
| Формиат аммония | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Формиат аммония | ||
| Традиционные названия | Аммоний муравьинокислый | ||
| Хим. формула | CH5NO2 | ||
| Рац. формула | HCOONH4 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 63,0559 г/моль | ||
| Плотность | 1,266 (при 20°C) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 116 °C | ||
| • разложения | 180 °C | ||
| Энтальпия | |||
| • образования | -567,5 (т) кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде |
102 (0°C) 142,7 (20°C) 204 (40°C) 311 (60°C) 531 г (80°C) |
||
| • в этаноле | растворим | ||
| • в жидком аммиаке | растворим | ||
| • в муравьиной кислоте |
54,6 (-3°C) 68,4 (8,5°C) 100 (21,5°C) 73 (21,5°C) 137 (39°C) 271,7 (78°C) смешивается (116°C) |
||
| Классификация | |||
| Рег. номер CAS | 540-69-2 | ||
| PubChem | 2723923 и 10904 | ||
| Рег. номер EINECS | 208-753-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | BQ6650000 | ||
| ChEBI | 63050 | ||
| ChemSpider | 10442 | ||
| Безопасность | |||
| ЛД50 |
2250 мг/кг (мыши, перорально) 410 мг/кг (мыши, внутривенно) |
||
| Токсичность | Класс опасности IV | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Формиат аммония — аммонийная соль муравьиной кислоты, бесцветные, гигроскопичные кристаллы. Имеет слабый запах аммиака.
Получение
[править | править код]Образуется при пропускании аммиака через муравьиную кислоту или смешивании их растворов:
Химические свойства
[править | править код]При нагревании формиата аммония отщепляется вода и образуется формамид, в чём и есть его основное применение в промышленности. При дальнейшем нагревании образуется цианистый водород (HCN) и вода. Побочной реакцией является разложение формамида на окись углерода (CO) и аммиак.
Из формиата аммония можно получить иные соли аммония или формиаты действием сильных кислот или оснований соответственно:
В воде подвергается гидролизу по аниону и катиону:
Использование
[править | править код]Формиат аммония используется для восстановительного аминирования альдегидов и кетонов (реакция Лейкарта)[1]. Наряду с ацетатом аммония используется в качестве вещества, способствующего ионизации молекул в электроспрее.
Также формиат аммония может использоваться в качестве элюента для разделения бария и радия по методике Сугимуры и Цуботы[2].
Опасность
[править | править код]Относится к малоопасным веществам (IV класс опасности).
Примечания
[править | править код]- ↑ 1..3.1 Hydride Transfer from Formic Acid // Comprehensive organic synthesis. Selectivity, Strategy & Efficiency in Modern Organic Chemistry. — Kidlington, Oxford: Pergamon Press, 1991. — Vol. 8. — P. 84. — ISBN 0-08-040599-1.
- ↑ Sugimura Y., Tsubota H. J., Marine Res., 21, 74 (1963)
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
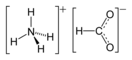



![{\displaystyle {\ce {HCOONH4 ->[t] HCONH2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/666110bfa98ba63cc4144f2996824436065bde64)
![{\displaystyle {\ce {HCOONH4 ->[t] HCN + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d536502f987433fb0f41335d5a74e9362b2b3e3)
![{\displaystyle {\ce {HCONH2 ->[t] NH3 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23e69d029637896cbdb103f7aee124bfaa9955ef)


