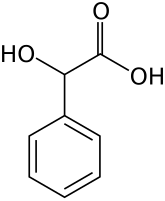
Миндальная кислота
| Миндальная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
2-Гидрокси-2-фенилэтановая кислота |
| Традиционные названия |
Миндальная кислота, гидроксифенилгликолевая кислота, α-гидроксифенилуксусная кислота |
| Хим. формула | C8H8O3 |
| Рац. формула | С6H5CH(OH)COOH |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 152,1473 ± 0,0079 г/моль |
| Плотность | 1,30 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 119 °C |
| • кипения | 321,8 °C |
| • вспышки | 162,6 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 3,37 |
| Растворимость | |
| • в воде | 15,87 г/100 мл |
| • в бензоле | 0,085 г/100 мл[1] |
| • в этаноле (16,5 °C) | 115,5 г/100 мл [1] |
| Оптические свойства | |
| Показатель преломления | 1,5204 |
| Классификация | |
| Рег. номер CAS |
90-64-2, 611-71-2 (R), 17199-29-0 (L) |
| PubChem | 1292 |
| Рег. номер EINECS |
202-007-6, 241-240-8 D или S(+) |
| SMILES | |
| InChI | |
| RTECS | OO6300000 |
| ChEBI | 35825 |
| ChemSpider | 1253 |
| Безопасность | |
| ЛД50 | 300 мг/кг (крысы, внутримышечно) |
| Токсичность | умеренно-токсична для мелких млекопитающих, едкое вещество, обладает раздражающими свойствами. |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Миндальная кислота, или фенилгликолевая кислота, — первый представитель жирно-ароматических гидроксикислот. Существует в двух энантиомерных оптически деятельных формах (R и S), а также в рацемической оптически неактивной (RS) форме, известной как параминдальная кислота. Она была получена К. А. Винклером при нагревании сырого горько-миндального масла с соляной кислотой.
Получение
[править | править код]Миндальную кислоту синтезируют несколькими путями:
- Путём гидролиза амигдалина с соляной кислотой — при этом образуется природная или L-миндальная кислота
- Синтез из бензальдегида (через гидролиз циангидрина):
1-я стадия: ;
2-я стадия:
[2].
Однако в этом случае образуется параминдальная кислота. Присутствие оптически активных оснований катализирует преимущественное образование какой-либо одной оптически активной формы[3].
Строение
[править | править код]Миндальная кислота содержит один асимметрический атом углерода (при гидроксильной группе), поэтому оптически активна. На её примере изучены многие вопросы стереохимии, в частности явления асимметрического синтеза.
Физические свойства
[править | править код]Миндальная кислота представляет собой бесцветное твёрдое кристаллическое вещество, малорастворимое в воде, хорошо в полярных органических растворителях — в спиртах и диэтиловом эфире, плохо растворяется в бензоле и неполярных органических растворителях, в хлороформе.
Химические свойства
[править | править код]Обладает свойствами спиртов и карбоновых кислот.
Нахождение в природе
[править | править код]В природе миндальная кислота встречается только в связанном виде. Нитрил миндальной кислоты , связанный с дисахаридом генциобиозой, находится в миндале и в косточках других плодов семейства розоцветных.
Применение
[править | править код]В медицине и косметике
[править | править код]Миндальная кислота обладает антисептическими свойствами: ещё до открытия антибиотиков эту кислоту в виде солей аммония или кальция широко использовали в урологии для лечения инфекционных заболеваний мочевыводящих путей[2]. В косметике миндальную кислоту широко используют в качестве средства для пилинга кожи, так как она имеет выраженный кератолический эффект и хорошо обновляет клетки эпидермиса (тем самым стимулирует синтез коллагена), отслаивая ороговевшие частицы кожи, также входит в состав различных комедонолитических средств (крема, мази и т. д.).
В аналитической химии
[править | править код]- Миндальная кислота представляет собой качественный реактив на цирконий, причём определению последнего не мешает присутствие титана, железа, алюминия, хрома, ванадия, редкоземельных металлов и молибдена[4].
- Миндальная кислота применяется также для отделения скандия от лантанидов и небольших количеств тория[5].
Безопасность
[править | править код]Миндальная кислота относится к малотоксичным веществам, однако, в концентрированном виде представляет собой довольно едкое вещество и может вызывать ожоги кожи. В больших концентрациях (60—75 %) является кожным ирритантом. При попадании на кожу она вызывает сильное раздражение, покраснение и образование волдырей.
Примечания
[править | править код]- ↑ 1 2 Справочник по растворимости.. — М.—Л.: ИАН СССР, 1962. — Т. 1. — С. 1089, 1143, 1228, 1295.
- ↑ 1 2 Дженкинс Г., Хартунг У. Химия органических лекарственных препаратов. — М.: Государственное издательство иностранной литературы, 1949. — 740 с.
- ↑ Степаненко Б. Н. Курс органической химии. — М.: Высшая школа, 1966. — 564 p.
- ↑ Сонгина О. А. Редкие металлы. — М.: Металлургия, 1964. — 568 с.
- ↑ Бусев А. И. Практическое руководство по аналитической химии редких элементов. — М.: Химия, 1966. — 410 с.




