Коллагеновая спираль
| Тройная спираль коллагена | |
|---|---|
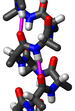
![Модель коллагеновой спирали[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/1K6F_Crystal_Structure_Of_The_Collagen_Triple_Helix_Model_Pro-_Pro-Gly103_04.png/274px-1K6F_Crystal_Structure_Of_The_Collagen_Triple_Helix_Model_Pro-_Pro-Gly103_04.png) Модель коллагеновой спирали[1] | |
| Идентификаторы | |
| Pfam | PF01391 |
| SCOP | 1a9a |
| SUPERFAMILY | 1a9a |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |

Тройная спираль коллагена или спираль типа 2 является основной вторичной структурой различных типов волокнистого коллагена, включая коллаген типа I. Он состоит из тройной спирали, состоящей из повторяющейся аминокислотной последовательности глицин -X-Y, где X и Y часто представляют собой пролин или гидроксипролин[2][3]. Коллаген, свернутый в тройную спираль, известен как тропоколлаген. Тройные спирали коллагена часто связаны в фибриллы, которые сами образуют более крупные волокна, как в сухожилиях.
Структура
[править | править код]Глицин, пролин и гидроксипролин должны находиться в назначенных положениях с правильной конфигурацией. Например, гидроксипролин в положении Y увеличивает термическую стабильность тройной спирали, но не в положении X[4]. Термостабилизация также затрудняется, когда гидроксильная группа имеет неправильную конфигурацию. Из-за высокого содержания глицина и пролина коллаген не может образовывать регулярную структуру α-спиралей и β-листов. Три левозакрученных спиральных нити скручиваются, образуя правозакрученную тройную спираль[5]. Тройная спираль коллагена имеет 3,3 остатка на виток[6].
Каждая из трех цепей стабилизируется стерическим отталкиванием за счет пирролидиновых колец остатков пролина и гидроксипролина. Пирролидиновые кольца не мешают друг другу, когда полипептидная цепь принимает эту расширенную спиральную форму, которая намного более открыта, чем плотно скрученная форма альфа-спирали. Три цепи связаны друг с другом водородными связями. Донорами водородной связи являются пептидные NH-группы остатков глицина. Акцепторами водородной связи являются группы СО остатков на других цепях. Группа ОН гидроксипролина не участвует в образовании водородных связей, но стабилизирует транс-изомер пролина за счет стереоэлектронных эффектов, таким образом стабилизируя всю тройную спираль.
Размер коллагеновой спирали (суперспирали) составляет 2,9 Å (0,29 нм) на остаток. Центр тройной спирали коллагена очень маленький и гидрофобный, и каждый третий остаток спирали должен контактировать с центром[7]. Из-за очень маленького и тесного пространства в центре только небольшой водород боковой цепи глицина способен с ним взаимодействовать[7]. Этот контакт невозможен, даже если присутствует немного больший аминокислотный остаток, отличный от глицина.
Примечания
[править | править код]- ↑ Berisio R, Vitagliano L, Mazzarella L, Zagari A (February 2002). "Crystal structure of the collagen triple helix model [(Pro-Pro-Gly)(10)](3)". Protein Sci. 11 (2): 262—70. doi:10.1110/ps.32602. PMC 2373432. PMID 11790836.
- ↑ Arnab Bhattacharjee, Manju Bansal. Collagen Structure: The Madras Triple Helix and the Current Scenario // IUBMB Life (International Union of Biochemistry and Molecular Biology: Life). — 2005-03-01. — Т. 57, вып. 3. — С. 161–172. — ISSN 1521-6551 1521-6543, 1521-6551. — doi:10.1080/15216540500090710.
- ↑ Mohamed Saad. Low resolution structure and packing investigations of collagen crystalline domains in tendon using Synchrotron Radiation X-rays, Structure factors determination, evaluation of Isomorphous Replacement methods and other modeling. Thesis 300dpi (англ.). — 1994. — doi:10.13140/2.1.4776.7844.
- ↑ Rita Berisio, Luigi Vitagliano, Lelio Mazzarella, Adriana Zagari. Crystal structure of the collagen triple helix model [(Pro-Pro-Gly)103] (англ.) // Protein Science. — 2009-04-13. — Vol. 11, iss. 2. — P. 262–270. — doi:10.1110/ps.32602.
- ↑ Bella, Jordi.
- ↑ Harpers Illustrated Biochemistry, 30th edition
- ↑ 1 2 Brodsky, Barbara, et al.