Структура жидкостей и стёкол
Структура жидкостей, стёкол и других некристаллических твёрдых частиц характеризуется отсутствием дальнего порядка, который определяет строение кристаллических материалов. Однако жидкости и аморфные твёрдые вещества обладают богатым и разнообразным ближним и средним упорядочением, который возникает в результате образования химических связей и других связывающих взаимодействий. Металлические стёкла, например, обычно хорошо описываются плотной случайной упаковкой твёрдых сфер, тогда как ковалентные системы, такие как силикатные стёкла, имеют редко упакованные, сильно связанные, тетраэдрические сетчатые структуры. Эти различия в структуре приводят к материалам с принципиально разными физико-химическими свойствами и к применению в совершенно различных сферах науки и техники.
Цель исследования структуры жидкостей и стёкол — понять их поведение, физические и химические свойства, чтобы их можно было объяснить, спрогнозировать и адаптировать для конкретных применений. Поскольку структура и вытекающее из этого поведение жидкостей и стёкол — сложная проблема многих тел, исторически эта задача была слишком сложна для вычислений, чтобы решать её непосредственно с помощью аппарата квантовой механики. Вместо этого для экспериментального и теоретического исследования структуры этих состояний наиболее часто используются различные методы дифракции, ЯМР, молекулярной динамики и моделирования Монте-Карло.

Парные функции распределения и структурные факторы[править | править код]
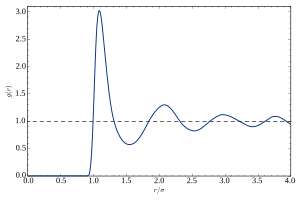
Парная функция распределения (или парная корреляционная функция) материала описывает вероятность нахождения атома на расстоянии r от другого атома.
Типичный участок g против r жидкости или стекла показывает ряд ключевых особенностей:
- При коротких расстояниях (малые r) g(r) = 0. Это указывает на эффективную ширину атомов, что ограничивает их расстояние приближения.
- Присутствует ряд очевидных пиков и впадин. Эти пики указывают на то, что атомы упаковываются вокруг друг друга в «оболочках» ближайших соседей. Обычно 1-й пик в g(r) характеризует самое сильное взаимодействие. Он связан с относительно сильными химическими связями и эффектами отталкивания между соседними атомами в 1-й оболочке.
- Ослабление пиков при увеличении радиальных расстояний от центра указывает на уменьшение степени упорядоченности при удалении от центральной частицы. Эта особенность распределения ярко иллюстрирует отсутствие «дальнего порядка» в жидкостях и стёклах.
- На больших расстояниях g(r) приближается к предельному значению 1, что соответствует макроскопической плотности материала.
Статический структурный фактор S(q), который можно измерить дифракционными методами, связан с соответствующим ему g(r) преобразованием Фурье
где q — величина вектора передачи импульса, а ρ — плотность материала. Подобно g(r), S(q) структура жидкостей и стёкол имеет ряд ключевых особенностей:
- Для одноатомных систем предел S(q=0) связан с изотермической сжимаемостью. Также повышение в нижнем пределе q указывает на наличие рассеяния на малых углах из-за крупномасштабной структуры или пустот в материале.
- Самые острые пики (или впадины) в S(q) обычно наблюдаются в диапазоне q=1-3 Ангстрем. Они обычно указывают на наличие некоторого среднего порядка дальности, соответствующего структуре во 2-й и более высоких координационных оболочках в g(r) .
- При высоком q структура, как правило, представляет собой затухающее синусоидальное колебание с длиной волны 2π/r1, где r1 — это положение первого пика оболочки в g(r).
- При очень высоком q S(q) стремится к 1, что согласуется с его определением.
Дифракция[править | править код]
Отсутствие дальнего порядка в жидкостях и стёклах подтверждается отсутствием брэгговских пиков в рентгеновской дифрактометрии и нейтронографии. Для этих изотропных материалов дифракционная картина имеет круговую симметрию, а в радиальном направлении интенсивность дифракции имеет плавную колебательную форму. Эту дифрагированную интенсивность обычно анализируют для получения статического структурного фактора S(q), где q задается как q=4πsin(θ)/λ, где 2θ — угол рассеяния (угол между падающим и рассеянным квантами), а λ — длина волны падающего излучения (рентгеновского кванта или нейтрона). Обычно дифракционные измерения выполняются при одном (монохроматическом) λ, а интенсивность дифракции измеряется в диапазоне углов 2θ, достаточном для получения широкого диапазона q. В качестве альтернативы может использоваться диапазон λ, позволяющий проводить измерения интенсивности при фиксированном 2θ или узком диапазоне 2θ. В дифракции рентгеновских лучей такие измерения обычно называют «энергетической дисперсией», тогда как в дифракции нейтронов это обычно называется «временем пролёта», чтобы различать используемые методы обнаружения. Как только S(q) экспериментально получено, полученная зависимость может быть преобразована методом Фурье, чтобы обеспечить соответствующую функцию радиального распределения (или функцию парной корреляции), обозначенную в этой статье как g(r). Для изотропного материала соотношение между S(q) и его соответствующим g(r) имеет вид
Функция g(r), которая описывает вероятность нахождения атома на расстоянии r от другого атома, дает более интуитивное описание атомной структуры. Диаграмма g(r), полученная из дифракционных измерений, представляет собой пространственное и тепловое среднее всех парных корреляций в материале, взвешенных по их когерентным сечениям с падающим пучком.
Атомистическое моделирование[править | править код]
По определению g(r) относится к среднему количеству частиц, обнаруженных в данном объёме оболочки, расположенной на расстоянии r от центра. Средняя плотность атомов на данном радиальном расстоянии от другого атома определяется по формуле:
где n(r) представляет собой среднее число атомов в оболочке шириной Δr на расстоянии r.[1] g(r) можно легко рассчитать путем построения гистограммы разделения частиц с использованием следующего уравнения
где Nа есть число а-частиц, |rij| является величиной разделения пары частиц i, j. Атомистическое моделирование может также использоваться в сочетании с потенциальными функциями межатомных пар для расчета макроскопических термодинамических параметров, таких как внутренняя энергия, свободная энергия Гиббса, энтропия и энтальпия системы.
Другие методы[править | править код]
Другие экспериментальные методы, часто используемые для изучения структуры стёкол, включают ядерно-магнитный резонанс (ЯМР), тонкую структуру поглощения рентгеновских лучей (XAFS) и другие методы спектроскопии, включая спектроскопию комбинационного рассеяния. Экспериментальные измерения можно сочетать с методами компьютерного моделирования, такими как моделирование методом обратного Монте-Карло (RMC) или молекулярной динамики (MD), для получения более полного и подробного описания атомной структуры.
Сетчатая структура стёкол[править | править код]


Ранние теории, относящиеся к структуре стекла, включали теорию кристаллитов, согласно которой стекло представляет собой совокупность кристаллитов (чрезвычайно мелких кристаллов).[2] Однако структурные исследования стеклообразных SiO2 и GeO2, сделанные Уорреном и его сотрудниками в 1930-х годах с использованием дифракции рентгеновских лучей, показали, что структура стекла является типичной для аморфного твердого вещества.[3] В 1932 году Захариасен представил теорию строения стекол как случайных сеток, в которой природа связи в стекле такая же, как в и кристалле, но основные структурные элементы стекла связаны случайным образом, в отличие от периодического расположения структурных мотивов в кристаллическом материале.[4] Несмотря на отсутствие дальнего порядка, структура стекла демонстрирует высокую степень упорядочения в ближнем порядке на атомных масштабах из-за ограничений химической связи в локальных атомных многогранниках.[5] Например, тетраэдры SiO4, которые образуют фундаментальные структурные единицы в кварцевом стекле, представляют высокую степень упорядоченности, то есть каждый атом кремния координируется 4-мя атомами кислорода, а длина ближайшей соседней связи Si-O имеет только узкое распределение по всей структуре. Тетраэдры в диоксиде кремния также образуют сеть кольцевых структур, что приводит к упорядочению на средних масштабах длины, примерно до 10 Ангстрем.
Альтернативные представления о структуре жидкостей и стёкол включают модель междоузлий[6] и модель струноподобного коррелированного движения.[7] Компьютерное моделирование методом молекулярной динамики показывают, что эти две модели тесно связаны друг с другом.[8]

Компоненты из оксидного стекла могут быть классифицированы как формирователи сетевой структуры, интермедиаты или модификаторы сетевой структуры.[9] Традиционные формирователи сетевой структуры (например, кремний, бор, германий) образуют сильно сшитую сеть химических связей. Интермедиаты (например, титан, алюминий, цирконий, бериллий, магний, цинк) могут вести себя как сеткообразователь, так и модификатор сети, в зависимости от состава стекла.[10] Модификаторы сетевой структуры (кальций, свинец, литий, натрий, калий) изменяют структуру сети; они обычно присутствуют в виде ионов, компенсируемых соседними, не связанными, атомами кислорода, связанными одной ковалентной связью со стеклянной сеткой и удерживающими один отрицательный заряд, чтобы компенсировать положительный ион поблизости.[11] Некоторые элементы могут играть несколько ролей; например, свинец может действовать как формирователь сети (Pb4+, заменяющий Si4+), так и как модификатор.[12] Присутствие не мостиковых атомов кислорода снижает относительное количество прочных связей в материале и разрушает сеть, уменьшая вязкость расплава и понижая температуру плавления.
Ионы щелочных металлов малы и подвижны; их присутствие в стекле позволяет повысить электрическую проводимость. Однако их подвижность снижает химическую стойкость стекла, приводя к выщелачиванию водой и облегчая коррозию. Щелочно-земельные ионы с их двумя положительными зарядами и необходимостью наличия двух несвязанных ионов кислорода для компенсации их заряда сами по себе гораздо менее мобильны и препятствуют диффузии других ионов, особенно щелочных. Наиболее распространенные коммерческие типы стекла содержат как щелочные, так и щелочноземельные ионы (обычно натрий и кальций) для облегчения обработки и обеспечения коррозионной стойкости. Коррозионная стойкость стекла может быть повышена путем деалкализации — удаления щелочных ионов с поверхности стекла[13] путем взаимодействия с соединениями серы или фтора.[14] Присутствие ионов щелочных металлов также оказывает вредное влияние на тангенс угла потерь стекла[15] и на его электрическое сопротивление.[16] Это необходимо учитывать при выборе стекол для электроники (уплотнения, вакуумные трубки, лампы и т. п.).
Кристаллический SiO2[править | править код]
Кремнезем (химическое соединение SiO2) имеет несколько различных кристаллических форм: кварц, тридимит, кристобалит и другие (в том числе высокого давления — полиморфные формы — стишовит и коэсит). Почти все они включают тетраэдрические единицы SiO4, связанные вместе общими вершинами в различных расположениях. Длина связи Si-O между различными кристаллическими формами варьируется. Например, в α-кварце длина связи составляет 161 пм, тогда как в α-тридимите она составляет 154—171 пм. Угол связи Si-O-Si также изменяется от 140° в α-тридимите до 144° в α-кварце и до 180° в β-тридимите.
Стеклообразный SiO2[править | править код]
В аморфном кремнеземе (плавленый кварц) тетраэдры SiO4 образуют сеть, которая не проявляет дальнего порядка. Однако сами тетраэдры представляют собой высокую степень локального упорядочения, то есть каждый атом кремния координируется 4 атомами кислорода, а длина ближайшей соседней связи Si-O имеет узкое распределение по всей структуре.[2] Если рассматривать атомную сеть кремнезема как механический каркас, эта структура является изостатической в том смысле, что число ограничений, действующих между атомами, равно числу степеней свободы последних. Согласно теории жёсткости, это позволяет материалу демонстрировать отличную способность к формованию.[17] Несмотря на отсутствие упорядочения в масштабах с дальним порядком, тетраэдры также образуют сеть кольцеобразных структур, которые приводят к упорядочению в масштабах среднего порядка (примерно до 10 Ангстрем или около того). При применении высокого давления (приблизительно 40 ГПа) кварцевое стекло подвергается непрерывному полиаморфному фазовому переходу в октаэдрическую форму, то есть атомы Si окружены 6 атомами кислорода вместо четырёх в тетраэдрическом стекле при атмосферном давлении.[18]
Примечания[править | править код]
- ↑ McQuarrie, D.A., Statistical Mechanics (Harper Collins, 1976)
- ↑ 1 2 Adrian C Wright. Neutron scattering from vitreous silica. V. The structure of vitreous silica: What have we learned from 60 years of diffraction studies? (англ.) // Journal of Non-Crystalline Solids[англ.] : journal. — 1994. — Vol. 179. — P. 84—115. — doi:10.1016/0022-3093(94)90687-4. — .
- ↑ B.E. Warren. The Diffraction of X-Rays in Glass (англ.) // Physical Review : journal. — 1934. — Vol. 45, no. 10. — doi:10.1103/PhysRev.45.657. — .
- ↑ W.H. Zachariasen. The Atomic Arrangement in Glass (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1932. — Vol. 54, no. 10. — doi:10.1021/ja01349a006.
- ↑ P.S. Salmon. Order within disorder (англ.) // Nature Materials : journal. — 2002. — Vol. 1, no. 2. — P. 87—8. — doi:10.1038/nmat737. — PMID 12618817.
- ↑ Granato A. V. Interstitialcy model for condensed matter states of face-centered-cubic metals (англ.) // Phys. Rev. Lett. : journal. — 1992. — Vol. 68, no. 7. — P. 974—977. — doi:10.1103/physrevlett.68.974. — . — PMID 10046046.
- ↑ Donati C., Glotzer S. C., Poole P. H., Kob W., Plimpton S. J. Spatial correlations of mobility and immobility in a glass-forming Lennard-Jones liquid (англ.) // Physical Review E : journal. — 1999. — Vol. 60, no. 3. — P. 3107—3119. — doi:10.1103/physreve.60.3107. — . — arXiv:cond-mat/9810060. — PMID 11970118.
- ↑ Nordlund K., Ashkenazy Y., Averback R. S., Granato A. V. Strings and interstitials in liquids, glasses and crystals (англ.) // Europhys. Lett.[англ.] : journal. — 2005. — Vol. 71, no. 4. — doi:10.1209/epl/i2005-10132-1. — .
- ↑ Glass Nanocomposites: Synthesis, Properties and Applications. — ISBN 978-0-323-39312-6.
- ↑ Fuel Cell Science and Engineering: Materials, Processes, Systems and Technology (англ.). — ISBN 978-3-527-65026-2.
- ↑ Radionuclide source term for HLW glass, spent nuclear fuel, and compacted hulls and end pieces (CSD-C waste) (англ.). — ISBN 978-3-86644-907-7.
- ↑ Zhu. MSE200 Lecture 19 (CH. 11.6, 11.8) Ceramics. Дата обращения: 15 октября 2017. Архивировано 27 апреля 2021 года.
- ↑ Baldwin, Charles. Advances in Porcelain Enamel Technology (англ.). — John Wiley & Sons. — ISBN 978-0-470-64089-0.
- ↑ Day, D. E. Glass Surfaces: Proceedings of the Fourth Rolla Ceramic Materials Conference on Glass Surfaces, St. Louis, Missouri, USA, 15–19 June, 1975 (англ.). — Elsevier. — ISBN 978-1-4831-6522-6.
- ↑ Zhou, Shiquan. Advances in Energy Science and Equipment Engineering: Proceedings of the International Conference on Energy Equipment Science and Engineering, (ICEESE 2015), May 30-31, 2015, Guangzhou, China (англ.). — CRC Press. — ISBN 978-1-315-66798-0.
- ↑ Scholze, Horst. Glass: Nature, Structure, and Properties (англ.). — Springer Science & Business Media. — ISBN 978-1-4613-9069-5.
- ↑ Phillips, J.C. Topology of covalent non-crystalline solids I: Short-range order in chalcogenide alloys (англ.) // Journal of Non-Crystalline Solids[англ.] : journal. — 1979. — Vol. 34, no. 2. — doi:10.1016/0022-3093(79)90033-4. — .
- ↑ C. J. Benmore. Structural and topological changes in silica glass at pressure (англ.) // Physical Review B : journal. — 2010. — Vol. 81, no. 5. — doi:10.1103/PhysRevB.81.054105. — .
Литература[править | править код]
- Френкель, Я. И. Кинетическая теория жидкостей. — Наука, 1975.
- Бартенев, Г. М. Строение и механические свойства неорганических стекол. — Издательство литературы по строительству, 1966.
- Скрышевский А. Ф. Структурный анализ жидкостей и аморфных тел. — 2-е изд., перераб. и доп.. — М.: Высшая школа, 1980. — С. 302—324. — 328 с.
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука, 1988. — 200 с. — ISBN 5-02-024564-X.
- Жукова, Л. А. Строение и свойства двойных металлических сплавов в жидком и аморфном состояниях. — УГТУ-УПИ, 2007.
- Таганцев, Д. К. Стеклообразные материалы. — Изд-во Политехн. ун-та, 2010.
- Шелби, Дж. Структура, свойства и технология стекла. — Мир, 2006. — ISBN 5-03-003585-0.
- Аппен, А. А. Химия стекла. — Химия, 1974.
- Порай-Кошиц, Е. А. Ликвационные явления в стеклах труды первого всесоюзного симпозиума. — Химия, 1970.
- Egelstaff, P.A. An Introduction to the Liquid State (англ.). — Oxford University Press, 1994. — ISBN 978-0198517504.
- Allen, M.P.; Tildersley, D.J. Computer Simulation of Liquids (англ.). — Oxford University Press, 1989. — ISBN 978-0198556459.
- Chris Benmore; Jeff Yarger. Structure of Disordered Materials. — Wiley-VCH Verlag GmbH, 2014. — ISBN 978-3527412716.
- Kawazoe,Y. and Waseda, Y. Structure and Properties of Aperiodic Materials (англ.). — Springer, 2010. — ISBN 978-3642056727.
Ссылки[править | править код]
- И. де-Бур. Теории жидкого состояния // Успехи физических наук. — Российская академия наук, 1953. — Т. 51, № 9. — С. 41—70. — doi:10.3367/UFNr.0051.195309b.0041.
- Santen, L.; Krauth W. Absence of a Thermodynamic Phase Transition in a Model Glass Former (англ.) // Nature : journal. — 2000. — Vol. 405, no. 6786. — P. 550—551. — doi:10.1038/35014561. — . — arXiv:cond-mat/9912182. — PMID 10850709.
- Fischer, H.E., Barnes, A.C., and Salmon, P.S. Neutron and x-ray diffraction studies of liquids and glasses (англ.) // Rep. Prog. Phys.[англ.] : journal. — 2006. — Vol. 69, no. 1. — P. 233—299. — doi:10.1088/0034-4885/69/1/R05. — .
![{\displaystyle S(q)-1={\frac {4\pi \rho }{q}}\int _{0}^{\infty }r[g(r)-1]\sin {(qr)}{d}r}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35a4d1b97434d18205f84eab4a8f5a9eb621af30)
![{\displaystyle g(r)-1={\frac {1}{2\pi ^{2}\rho r}}\int _{0}^{\infty }q[S(q)-1]\sin {(qr)}{d}q}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e522b1c8764454b3e076f4bc77f14467c746a60)

