Кармустин
| Кармустин | |
|---|---|
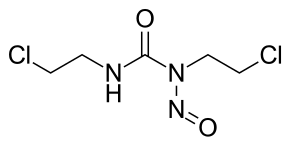 | |
| Химическое соединение | |
| Брутто-формула | C5H9Cl2N3O2 |
| CAS | 154-93-8 |
| PubChem | 2578 |
| DrugBank | DB00262 |
| Состав | |
| Классификация | |
| АТХ | L01AD01 |
Кармустин — цитостатический противоопухолевый химиотерапевтический лекарственный препарат алкилирующего типа действия из группы производных нитрозомочевины.
Фармакологическое действие
[править | править код]Противоопухолевое средство алкилирующего действия из группы производных нитрозомочевины. Действует на основания и фосфатные группы ДНК, что приводит к разрывам и сшивкам её молекулы. Является циклонеспецифичным соединением. Действие кармустина также может быть связано с модификацией белков.
Фармакокинетика
[править | править код]Быстро метаболизируется в печени с образованием активных метаболитов. Метаболиты могут сохраняться в плазме крови в течение нескольких суток. Проникает через ГЭБ. Выводится главным образом почками в виде метаболитов — 60-70 %, с калом — 1 %, через дыхательные пути — 10 %.
Показания
[править | править код]Опухоли мозга (глиобластома, глиома ствола мозга, медуллобластома, астроцитома, эпендимома), метастазирующие опухоли мозга; множественная миелома (в комбинации с преднизолоном); лимфогранулематоз (в комбинации с другими препаратами); неходжкинские лимфомы.
Режим дозирования
[править | править код]Устанавливают индивидуально, в зависимости от показаний и стадии заболевания, состояния системы кроветворения, схемы противоопухолевой терапии.
Побочное действие
[править | править код]Со стороны системы кроветворения: часто — миелодепрессия; возможна анемия. Со стороны пищеварительной системы: часто — тошнота, рвота; возможны проявления гепатотоксичности — повышение активности трансаминаз, ЩФ, уровня билирубина. Со стороны дыхательной системы: возможно возникновение инфильтратов и/или очагов фиброза в легких. Со стороны мочевыделительной системы: после длительного применения в высоких кумулятивных дозах — прогрессирующая азотемия, уменьшение размера почек. При быстром в/в введении: возможно ощущение жжения в месте инъекции, а также выраженное покраснение кожи и набухание конъюнктивы в течение 2-4 ч. Прочие: возможны нейроретинит, боли в грудной клетке, головная боль, аллергические реакции, артериальная гипотензия, тахикардия.
Противопоказания
[править | править код]Повышенная чувствительность к кармустину или другим производным нитрозомочевины.
Применение при беременности и кормлении грудью
[править | править код]Адекватных и строго контролируемых исследований безопасности применения кармустина при беременности у человека не проводилось. Имеются данные об эмбриотоксическом действии кармустина при беременности у человека. В экспериментальных исследованиях показано, что кармустин оказывает эмбриотоксическое действие при беременности у крыс и кроликов и тератогенное действие у крыс в дозах эквивалентных дозам, применяемым у человека. Женщинам детородного возраста в период лечения рекомендуется использовать надежные методы контрацепции. Неизвестно, выделяется ли кармустин с грудным молоком. При необходимости применения в период лактации следует прекратить грудное вскармливание.
Особые указания
[править | править код]В процессе лечения необходим контроль картины периферической крови, функции печени, почек и рентгенологическое исследование легких. Поскольку отличительной особенностью кармустина является отсроченное проявление угнетающего действия на кроветворение, контроль картины периферической крови следует проводить еженедельно в течение 6 недель после окончания применения.
Лекарственное взаимодействие
[править | править код]При одновременном применении с другими препаратами, вызывающими миелодепрессию, возможно аддитивное угнетение функции костного мозга; с препаратами, оказывающими гепато- или нефротоксическое действие — усиление проявлений гепато- или нефротоксичности.
Примечания
[править | править код]- ↑ Carmustine - Compound Summary. PubChem Compound. USA: National Center for Biotechnology Information (25 марта 2005). Дата обращения: 11 апреля 2012. Архивировано 21 февраля 2014 года.
Это заготовка статьи по фармакологии. Помогите Википедии, дополнив её. |